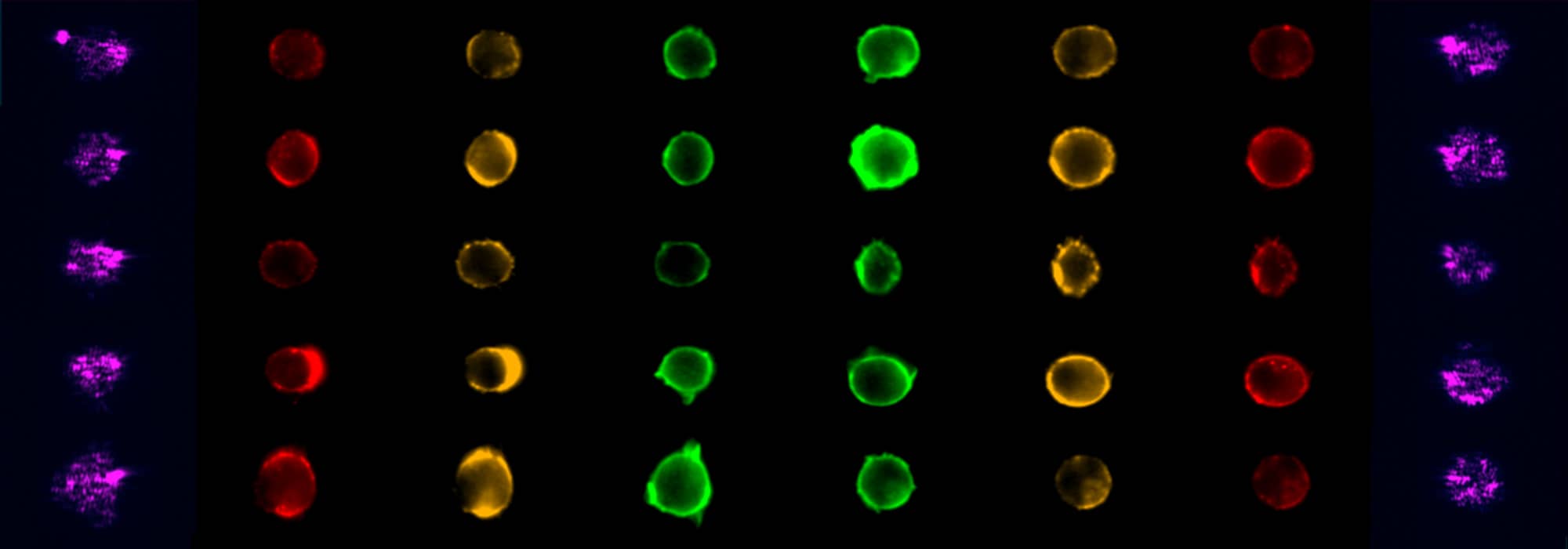
Imagerie et cytométrie (ImCy)
Imagerie et cytométrie pour la quantification des effets des thérapies sur les maladies rares, en particulier les maladies neuromusculaires.
Imagerie et cytométrie (ImCy)
Imagerie et cytométrie pour la quantification des effets des thérapies sur les maladies rares, en particulier les maladies neuromusculaires.
Imagerie et cytométrie (ImCy)
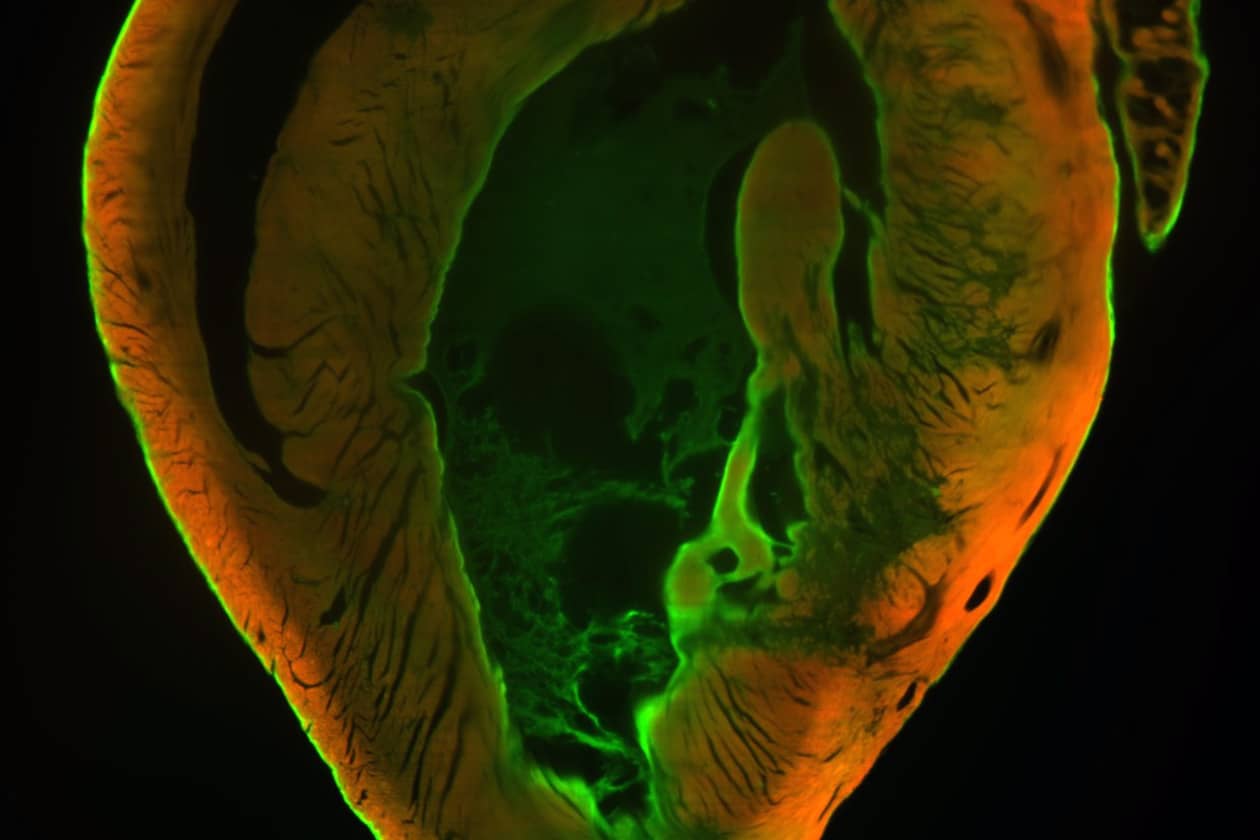
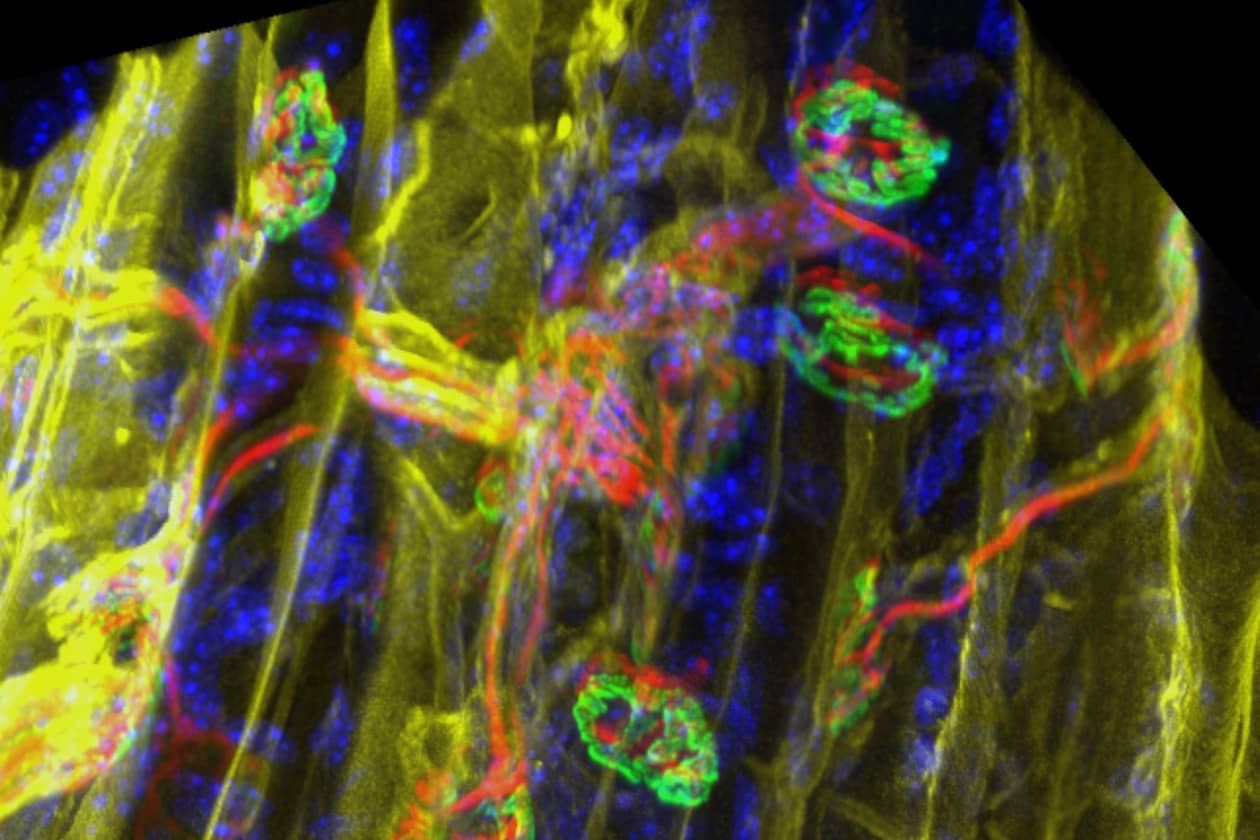
ImCy est la plateforme d'imagerie et cytométrie du Généthon, laboratoire leader de la thérapie génique pour les maladies rares. Elle soutient les projets de recherche scientifique académique et privée, en privilégiant le domaine des thérapeutiques pour le traitement des maladies rares et en particulier des maladies neuromusculaires. Elle offre à ses utilisateurs une expertise et des savoir-faire de pointe pour la réalisation d’expériences et le développement de nouvelles méthodologies utilisant les technologies de l’imagerie et de la cytométrie.
La plateforme propose un accompagnement de la conception des projets à l’analyse des données générées. Elle a également pour mission de former les utilisateurs sur son parc d’instruments qui permet, grâce à la complémentarité de l’imagerie et de la cytométrie, d’analyser des échantillons biologiques à différentes échelles. La plateforme s’investit ainsi sur des études intégratives et multimodales, depuis l’analyse du petit animal entier par bioluminescence jusqu’à la localisation de protéines en super résolution (STED), en passant par le phénotypage de populations cellulaires.
Expertises et services
Imagerie :
- Assistance et prestation pour l’acquisition d’images en imagerie de fluorescence plein champ et confocale, imagerie 3D par feuille de lumière, nanoscopie STED, vidéomicroscopie et microscopie holographique,
- Acquisition de lames virtuelles,
- Traitement d’images et développement à façon de logiciels et workflows,
- Formation théorique et pratique sur les équipements d’imagerie et les logiciels d’analyse d’images (Imaris, FIJI, ImageJ, QuPath, LAS X, ZEN...).
Cytométrie :
- Assistance et prestation pour l’acquisition de données de cytométrie en flux conventionnelle, spectrale ou en images,
- Aide à la conception d’expériences et de panels d’analyses,
- Tri de cellules eucaryotes, du clonage au tri multivoies,
- Analyse de données multiparamétriques,
- Formation théorique et pratique sur les équipements de cytométrie et les logiciels d’analyse (FlowJo, Kaluza, Ideas).
Moyens et équipements
Microscopie plein champ en laboratoire L1 :
- Microscope à feuille de lumière Alpha3 (PhaseView) équipé de 4 lasers (488, 561, 633 et 742 nm) sous hotte chimique,
- Microscope motorisée et automatisé Axioscan Z1 (Zeiss) avec source de lumière LED Colibri 7 couleurs et chargeur 100 lames pour la numérisation de lames virtuelles en champ clair ou fluorescence,
- Microscope time lapse BioStation (Nikon) avec chambre thermostatée, possibilité de champ clair ou fluorescence, objectif x20 et lentilles x2 ou x4,
- Microscope par tomographie holographique en time lapse XF (Nanolive),
- Microscope de morphométrie droit à lumière blanche équipé d’une platine motorisée pour la numérisation de lames virtuelles,
- Microscope droit à fluorescence (Leica) équipé de 4 LED (UV, bleu, vert et rouge),
- Microscope de morphométrie inversé à fluorescence équipé de filtres polariseurs et d’une platine motorisée pour la numérisation de lames virtuelles,
- Microscope inversé à fluorescence équipé d’une caméra monochrome haute sensibilité,
- Microscope inversé EVOS FL (Life Technologies) sans oculaires avec 3 canaux d’excitations (UV, bleu, vert) pour la visualisation rapide de cultures cellulaires.
Microscopie confocale en laboratoire L1 :
- Microscope confocal TCS SP8 (Leica) équipé de 5 lasers (405, 488, 532, 552 et 635 nm), d’un scanner résonnant à 8 000 Hz et d’un module Gated-STED pulsé avec laser de déplétion à 775 nm pour la super résolution.
Imagerie in vivo en animalerie A2 :
- IVIS Lumina (PerkinElmer) pour l’imagerie corps entier du petit animal par bioluminescence ou fluorescence,
- Microscope confocal endoscopique fibré Cellvizio (Mauna Kea Technologies) équipé de 2 lasers (488 et 633 nm).
Microscopie holographique en laboratoire L2 :
- Microscope holographique time lapse HoloMonitor M4 équipé d’une platine motorisée et placé dans un incubateur.
Cytométrie en laboratoire L2 :
- Trieur Astrios EQ (Beckman Coulter) avec 4 lasers (405, 488, 561 et 640 nm), 14 paramètres de fluorescence simultanés, FSC (forward scatter) et SSC (side scatter), tri de 1 à 6 voies sur plaques de 6 à 96 puits personnalisables,
- Analyseur spectral SP6800 (Sony Biotechnology) avec 3 lasers (405, 488 et 640 nm), paramètres par décomposition spectrale de 500 à 800 nm (32 PMT), 2 PMT supplémentaires, FSC et SSC,
- Analyseur en flux en images ImageStream MKII (Cytex) avec 4 lasers (488, 561, 620 et 742 nm), 5 paramètres de fluorescence simultanés, champ clair et SSC, option EDF et lecteur de plaque,
- Analyseurs CytoFLEX S (Beckman Coulter) avec 4 lasers (405, 488, 561 et 640 nm), 13 paramètres de fluorescence simultanés, FSC et SSC, et lecteur de plaque,
- Analyseurs CytoFLEX LX (Beckman Coulter) avec 6 lasers (375, 405, 488, 561, 640 et 808 nm), 21 paramètres de fluorescence simultanés, FSC et SSC, et lecteur de plaque.







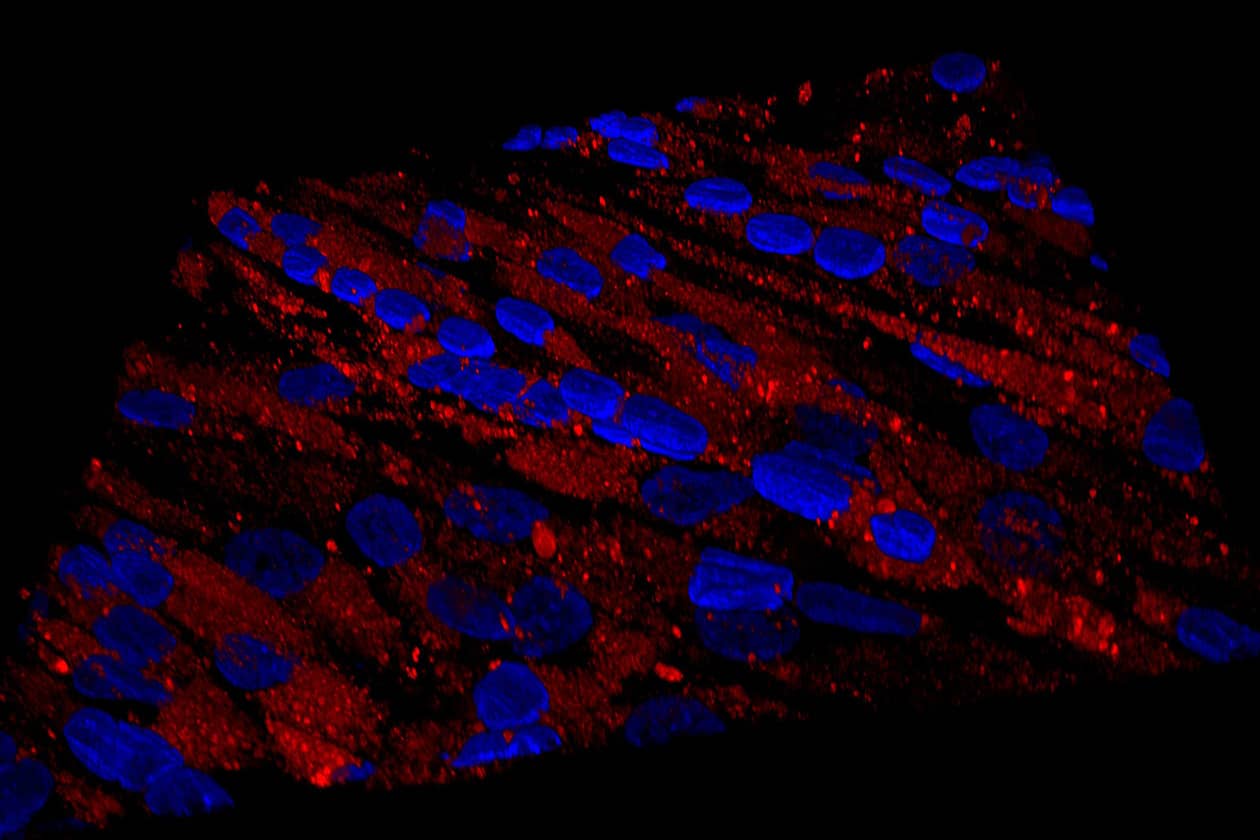
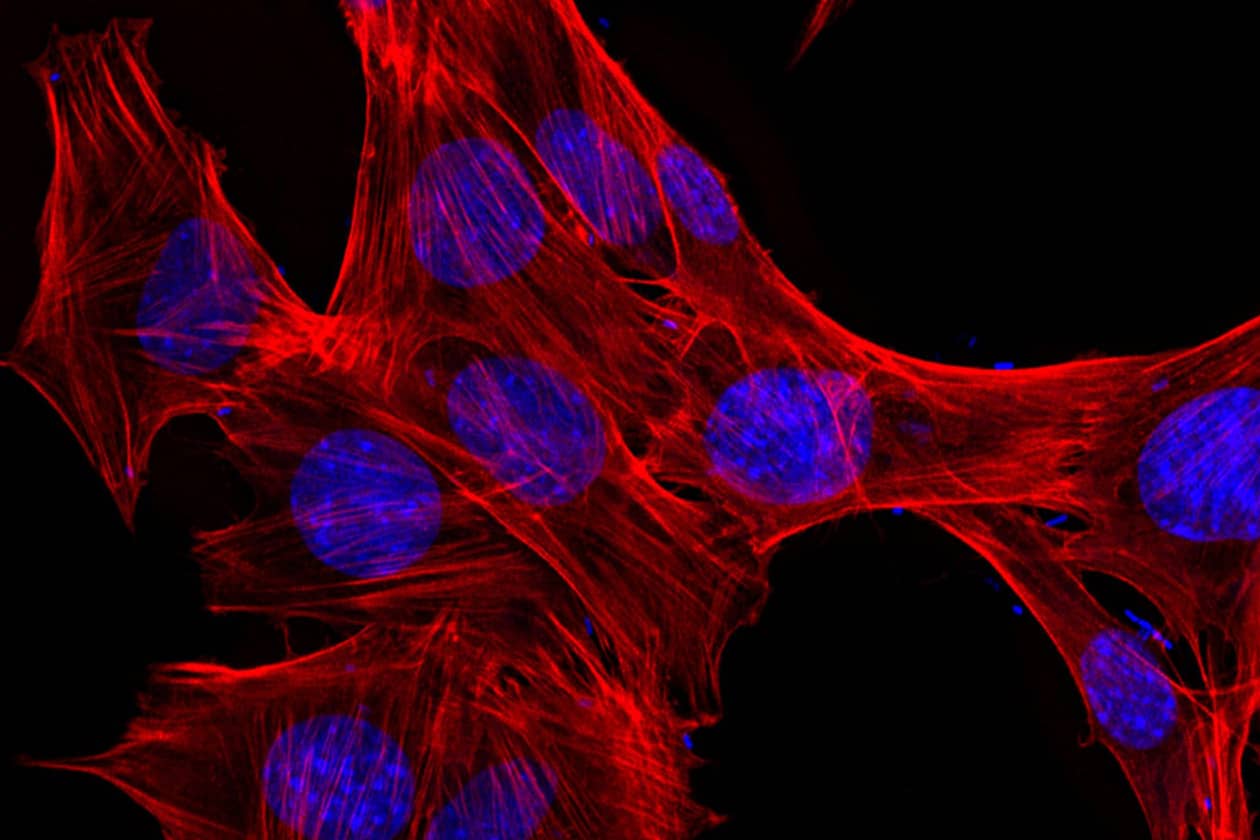
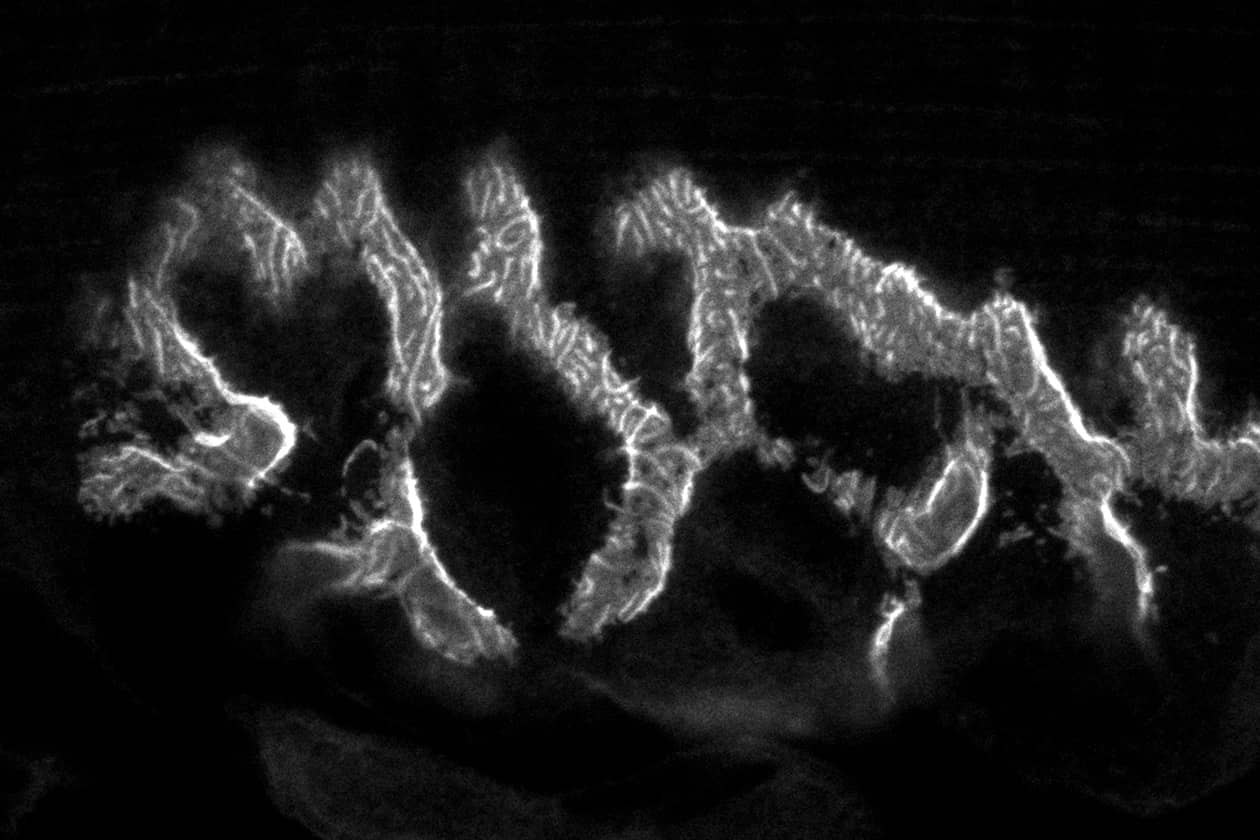
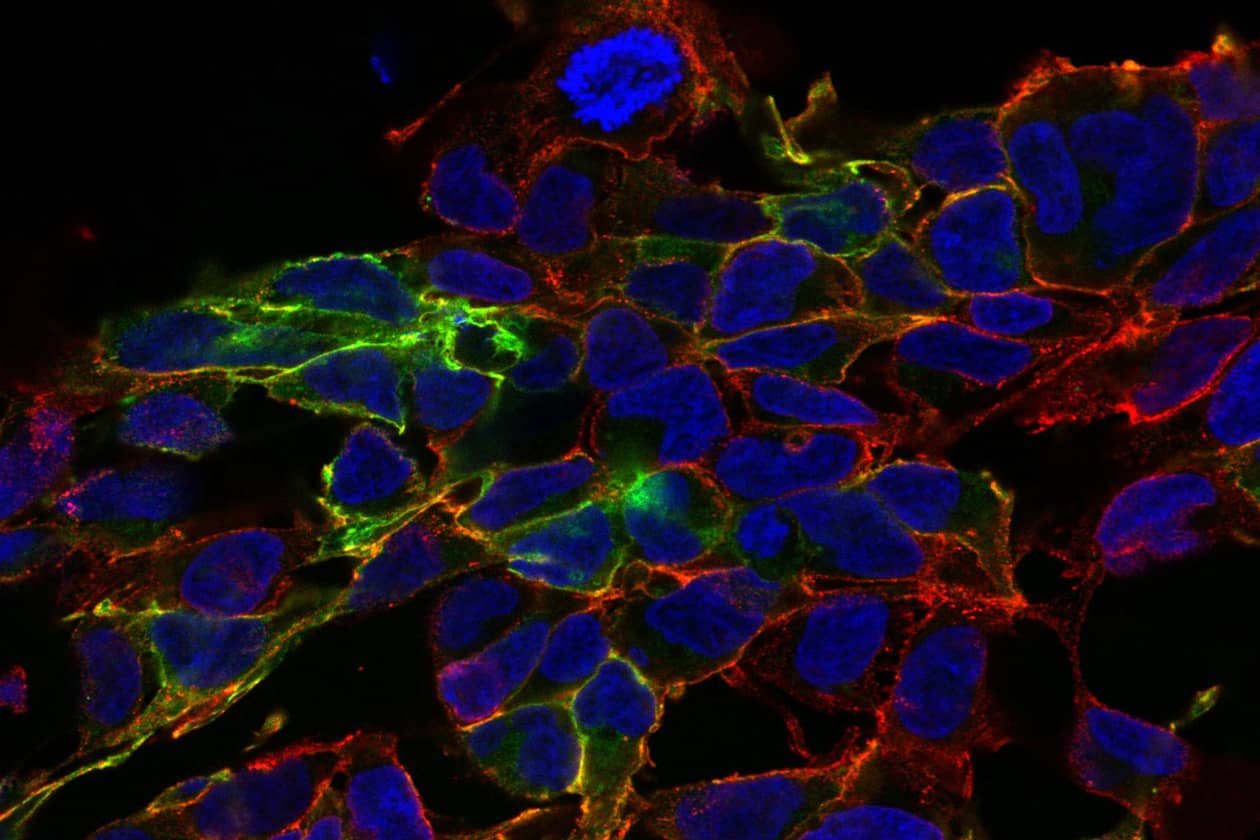
Comment soumettre un projet ?
Pour soumettre un projet ou une demande d’accès à la plateforme ImCy, vous pouvez envoyer un mail à l’adresse info-imagerie-cytometrie@genethon.fr. Un rendez-vous téléphonique ou en visio vous sera proposé pour étudier votre demande et vous présenter les solutions d’expertise ou d’accompagnement possibles. Les expériences démarreront après validation du cahier des charges et des documents administratifs. Les demandes sont généralement prises en charge dans un délai inférieur à 15 jours.
Exemple d'utilisation
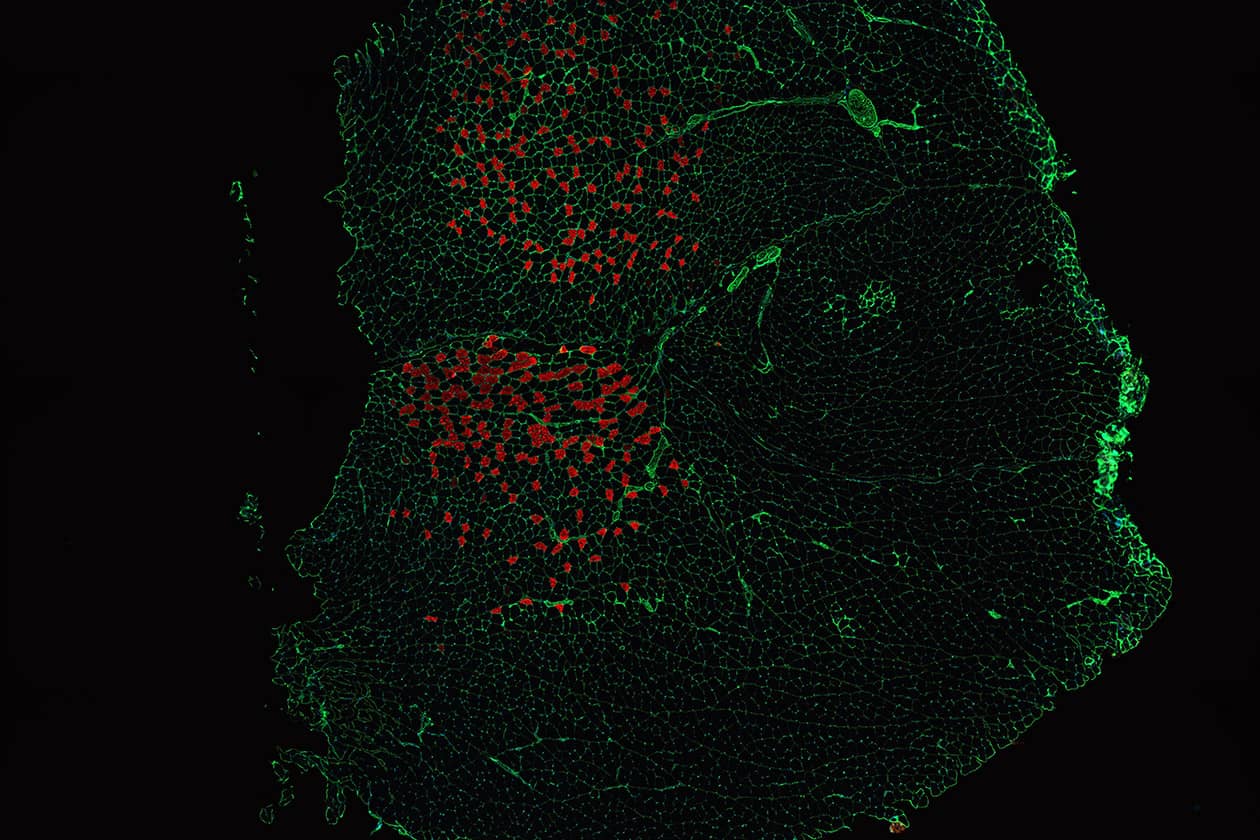
Quantification de la désorganisation d’un tissu
Le Laboratoire de génomique et de radiobiologie de la kératinopoïese (LGRK) de l’Institut de biologie François Jacob du CEA étudie les cellules souches de l'épiderme humain adulte. Son objectif principal est de caractériser les déterminants génétiques des cellules souches des kératinocytes (CSK), ainsi que les mécanismes permettant de maintenir leur stabilité génomique. L'équipe du LGRK a contacté la plateforme ImCy pour scanner des coupes histologiques et mettre en place une méthodologie d'analyse quantitative de l'organisation de l'épiderme.
Dans un modèle organoïde de xénogreffe traitée par une faible irradiation (50 mGy), les régions dysplastiques ont montré des caractéristiques de la transition épithélio-mésenchymateuse. Plus particulièrement, l’analyse quantitative mise au point par la plateforme a démontré que la polarité des kératinocytes basaux était perturbée. Ces résultats contribuent à mieux comprendre la prédisposition au cancer chez les patients atteints de xeroderma pigmentosum, la maladie des enfants de la lune.
Pour en savoir plus : Cavallero S. et al (2020). Exposure of human skin organoids to low genotoxic stress can promote epithelial-to-mesenchymal transition in regenerating keratinocyte precursor cells. Cells, 9(8):1912.
Contact
ImCy
1 bis rue de l’internationale
91000 Evry
Région : Île-de-France +33 (0)1 69 47 28 28
+33 (0)1 69 47 28 28
info-imagerie-cytometrie@genethon.fr
Site de la plateforme
THÉMATIQUES : Cytométrie, Imagerie cellulaire, Imagerie in vivo, radiobiologie, Autres
RESPONSABLES SCIENTIFIQUES :
Daniel Stockholm
RESPONSABLES TECHNIQUES :
Daniel Stockholm
TUTELLES : Généthon
INFRASTRUCTURES NATIONALES : France BioImaging
LABELLISATION IBiSA : 2021
MOTS CLÉS : Imagerie confocale, Nanoscopie STED, Super résolution, Microscopie holographique, Time lapse, Lame virtuelle, Imagerie sans marquage, Cytométrie en flux, Cytométrie spectrale en flux, Cytométrie sans marquage, Traitement de données multiparamétriques, Microscopie à feuille de lumière, Cytométrie en images, Traitement d’images, Intelligence artificielle, Maladie rare, Thérapie génique, Muscles, Maladies neuromusculaires
Fiche mise à jour en 2023











